Praca domow nr 8 zadanie 8.2
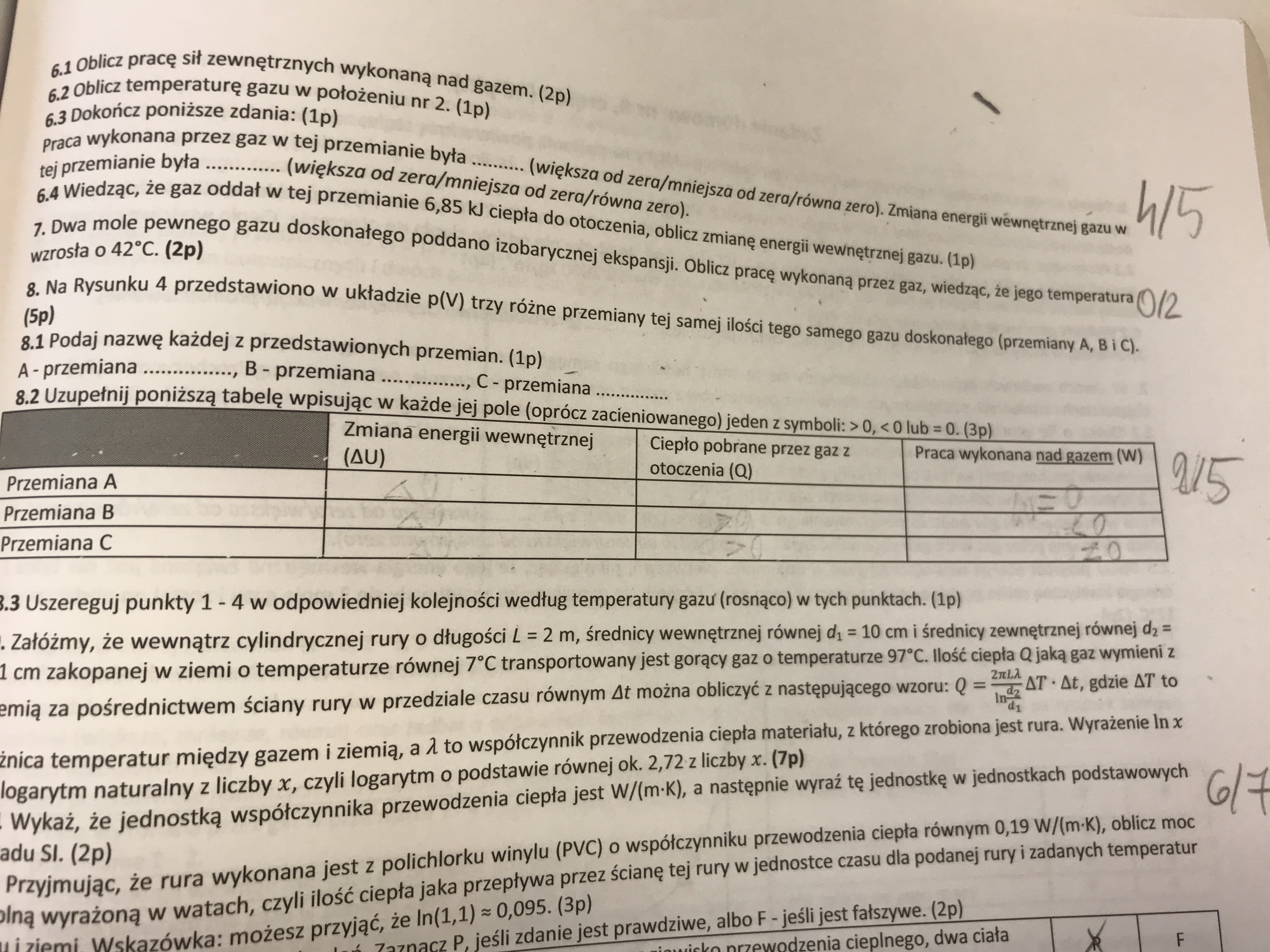
Nie potrafię wyznaczyć Ciepła pobranego oraz energii wewnętrznej. Mógłby ktoś mi powiedzieć co i jak?
Fizyka praca domowa Dodaj post do ulubionych Poproś o pomoc
- 1
- Zaloguj się lub zarejestruj, by móc oceniać komentarze.
- Dodaj do ulubionych
W odpowiedziach jest napisane, że w B ciepło pobrane przez otoczenie >0
- 0
- Zaloguj się lub zarejestruj, by móc oceniać komentarze.
- Dodaj do ulubionych
i co to za wzór Q = ncdeltaT>
czym jest c? kiedy możemy go stosować?
- 0
- Zaloguj się lub zarejestruj, by móc oceniać komentarze.
- Dodaj do ulubionych
No dokładnie - w przemianie B gaz pobiera ciepło, zatem Q > 0.
cp i cv w tych wzorach to ciepło molowe gazu odpowiednio przy stałym ciśnieniu (czyli w przemianie izobarycznej) i przy stałej objętości (w przemianie izochorycznej). Są to wzory pozwalające obliczyć ciepło Q pobrane (lub oddane) przez gaz właśnie w jednej z takich przemian. Możemy zatem tych wzorów używać zawsze gdy mamy do czynienia właśnie z przemianą izobaryczną lub izochoryczną.
- 0
- Zaloguj się lub zarejestruj, by móc oceniać komentarze.
- Dodaj do ulubionych
Jeśli chodzi o zmianę energii wewnętrznej, to musimy sprawdzić jak w danej przemianie zmieniała się temperatura (ponieważ energie wewnętrzna jest wprost proporcjonalna do temperatury). To zaś możemy wywnioskować z równania Clapeyrona: pV = nRT, a zatem pV/T = const, a zatem tam gdzie iloczyn pV wzrósł, tam wzrosła również temperatura. Stąd wnioskujemy, że w przemianie A temperatura zmalała, w przemianie B była stała, a w przemianie C wzrosła. Na tej podstawie wnioskujemy, że zmiana energii wewnętrznej była w tych przemianach odpowiednio mniejsza, zerowa i większa od zera.
Jeśli chodzi zaś o ciepła, to w przypadku przemiany A i C (izochorycznej i izobarycznej), możemy posłużyć się wzorami: $$ Q_A = n c_v \Delta T $$ oraz $$ Q_C = n c_p \Delta T $$ i widzimy, że w tej przemianie gdzie temperatura wzrosła, ciepło zostało pobrane przez gaz (większe od zera), a w przemianie gdzie temperatura malała ciepło było oddawane przez gaz. W przypadku przemiany B (izotermicznej) najlepiej jest natomiast posłużyć się I zasadą termodynamiki - wiemy już jaka jest w niej zmiana energii wewnętrznej oraz jaka jest wykonana praca, więc stąd obliczymy pobrane ciepło.