Gracjan 499 wyśw.
28-11-2022 22:06
Zadanie 2 strona 337 zestaw 2

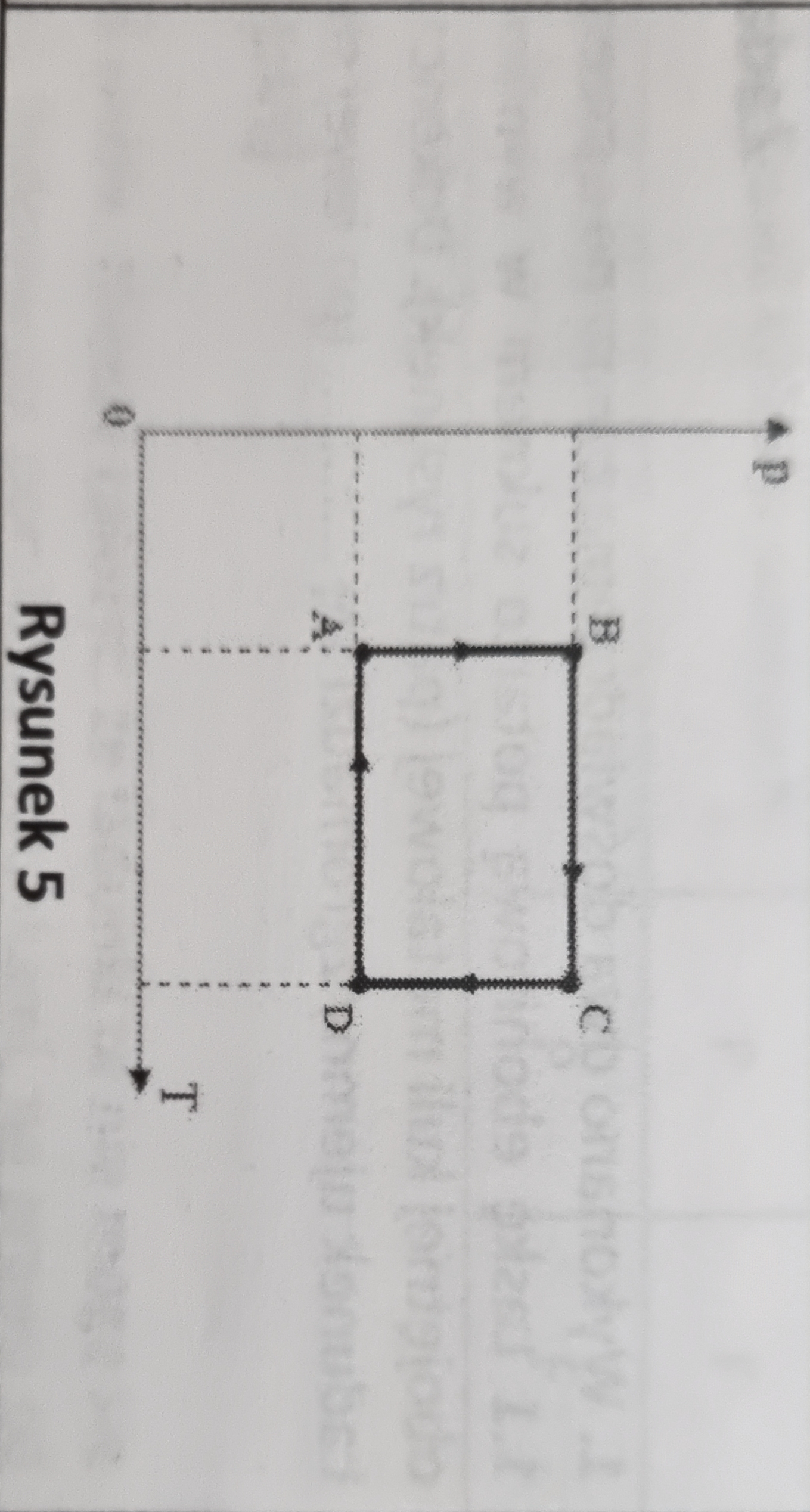
Wytłumaczyć mi ktoś czym się posługujemy żeby wywnioskować te wszystkie znaki?
Fizyka Dodaj post do ulubionych Poproś o pomoc
Kliknij tutaj, aby dodać nowy komentarz.
Zaloguj się lub zarejestruj, by móc dodawać komentarze.
s.gugula
29-11-2022 13:19
- 1
- Zaloguj się lub zarejestruj, by móc oceniać komentarze.
- Dodaj do ulubionych
Zacznijmy od energii wewnętrznej - ta jest tym większa, im większa jest temperatura. A zatem w przemianach, w których temperatura rośnie, zmiana energii wewnętrznej jest dodatnia, gdy temperatura maleje, to zmiana en. wewn. jest ujemna, a przy braku zmiany temperatury jest ona zerowa. Jeśli chodzi o pracę, to należy wiedzieć jak w danej przemianie zmienia się objętość gazu, a to można wywnioskować z równania Clapeyrona, a w szczególności z zależności pV/T = const. A zatem np. w przemianie AB rośnie p i nie zmienia się T, a zatem skoro pV/T = const, to objętość V musiała zmaleć. Gdy objętość gazu maleje, to praca wykonana przez gaz jest ujemna, gdy rośnie, to jest dodatnia, a gdy nie zmienia się, to praca jest zerowa. No i takie rozumowanie możemy przeprowadzić dla każdej przemiany. Z ciepłem radzimy sobie dwoma sposobami, w zależności od przemiany. Jeśli przemiana jest izobaryczna, to zgodnie ze wzorem wykorzystującym ciepło molowe pobrane ciepło to Q = n*cp*deltaT. Jeśli zatem deltaT > 0 (temp. rośnie), to Q > 0, czyli ciepło jest pobierane. No i analogicznie gdy temperatura maleje, to ciepło jest oddawane. Natomiast w przypadku przemian izotermicznych (AB i CD) należy wykorzystać I zasadę termodynamiki i wiedzę o tym jaka jest praca i o tym, że zmiana energii wewnętrznej jest zerowa. Wówczas z I zasady termodynamiki widzimy, że 0 = Q + W, czyli Q = -W. Przypominam jednak, że we wzorze na pierwszą zasadę termodynamiki, W jest pracą sił zewnętrznych, ma ona więc znak przeciwny do pracy gazu! W razie dalszych pytań proszę śmiało pytać.
PS: dla wygodniejszego czytania postu zalecam stosowanie opcji wklejania obrazów podczas pisania posta (znaczek obrazka na pasku narzędzi).