Arkusz 8 zadanie 5

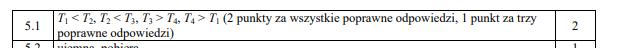
Dlaczego ciepło T2 jest większe od ciepła T1 jeśli przemiana 1 - 2 jest adiabatyczna czyli gaz w niej nie wymienia ciepła? (to samo pytanie do T3 i T4)
Zmiana temperatury ciepło przemiana adiabatyczna Dodaj post do ulubionych Poproś o pomoc
- 1
- Zaloguj się lub zarejestruj, by móc oceniać komentarze.
- Dodaj do ulubionych
Przyrównujemy tutaj temperatury gazu, a nie ciepła - to są dwie różne rzeczy! Można to wywnioskować z I zasady termodynamiki, czyli deltaU = Q + W. I tak jak wspomniałeś w przemianach adiabatycznych ciepło nie jest wymieniane, więc Q = 0. A zatem dostajemy deltaU = W. Widzimy, że w przemianie 1-2 objętość gazu maleje, czyli wykonana nad nim praca przez siły zewnętrzne jest dodatnia, czyli W > 0 (to jest to W, które siedzi właśnie w I zasadzie termodynamiki). Stąd wnioskujemy, że deltaU > 0. Oznacza to, że zmiana energii wewnętrznej gazu w tej przemianie była dodatnia, a energia wewnętrzna gazu jest wprost proporcjonalna do jego temperatury, oznacza to zatem jednocześnie, że temperatura gazu wzrosła w przemianie 1-2.
Analogicznie w przemianie 3-4 temp. gazu zmalała.