2013.3 strona 123
Jak rozwiązać 3.2. skoro nie znamy zależności między temperaturami lub średnimi energiami kinetycznymi?
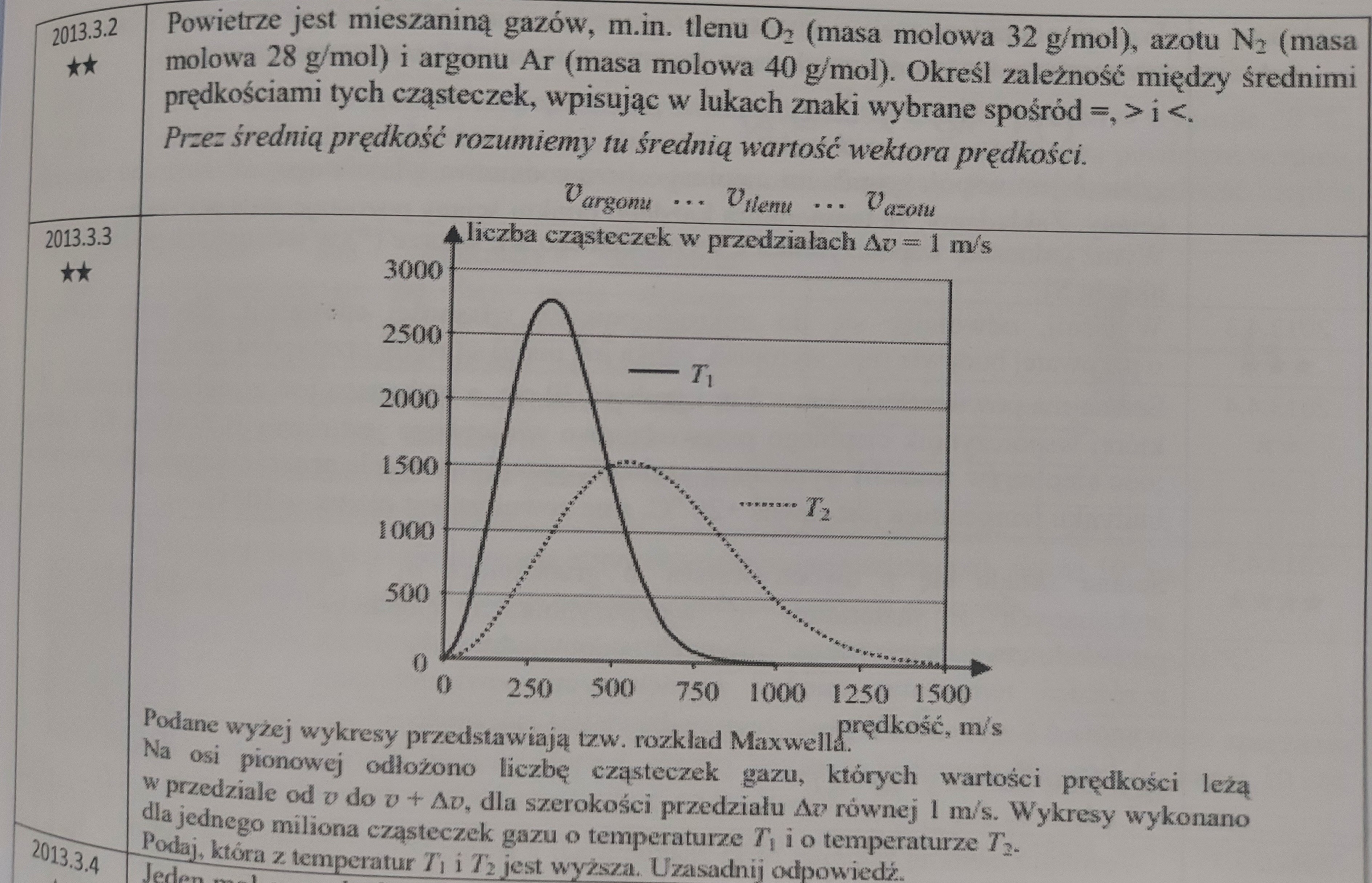
Nie rozumiem także tego wykresu w 3.3.
Fizyka termodynamika Dodaj post do ulubionych Poproś o pomoc
- 1
- Zaloguj się lub zarejestruj, by móc oceniać komentarze.
- Dodaj do ulubionych
A czy ilość moli tych gazów jest taka sama?
- 0
- Zaloguj się lub zarejestruj, by móc oceniać komentarze.
- Dodaj do ulubionych
Bo mi wyszło takie coś:
- 0
- Zaloguj się lub zarejestruj, by móc oceniać komentarze.
- Dodaj do ulubionych
I jak odczytać ten wykres?
- 0
- Zaloguj się lub zarejestruj, by móc oceniać komentarze.
- Dodaj do ulubionych
Przy takim przejściu jak Ty zrobiłeś to należy faktycznie założyć, że ilość moli jest taka sama, natomiast już krok wcześniej można zakończyć to rozumowanie, czyli na zapisie, gdzie w mianowniku masz samo m. Jest to bowiem masa cząsteczki gazu, a z treści zadania wiemy, że mAr > mO2 > mN2 (skoro bowiem taka jest zalezność między masami molowymi, to taka również jest zależność między masami cząsteczek tych gazów).
Co do interpretacji wykresu, to należy zauważyć, że średnia prędkość jest większa dla temperatury T2 niż dla temperatury T1 (można przyjąć w przybliżeniu, że średnia prędkość to ta, dla której "mniej więcej" pojawia się maksimum w obu przypadkach). Jeśli zaś średnia prędkość jest większa w temperaturze T2 niż T1, to musi to oznaczać, że T2 > T1 (bo przecież Ek ruchu postępowego = 3/2 *kb * T).
- 1
- Zaloguj się lub zarejestruj, by móc oceniać komentarze.
- Dodaj do ulubionych
- 0
- Zaloguj się lub zarejestruj, by móc oceniać komentarze.
- Dodaj do ulubionych
Czyli w 3.3.: V2max=1500m/s i V1max=1000m/s zatem T2>T1?
- 0
- Zaloguj się lub zarejestruj, by móc oceniać komentarze.
- Dodaj do ulubionych
Tak, zależność między masami (pojedynczych cząsteczek, nie całego gazu) jest taka jak między masami molowymi.
3.3: Tak, taki wniosek też jest ok.
- 1
- Zaloguj się lub zarejestruj, by móc oceniać komentarze.
- Dodaj do ulubionych
Znamy zależność między temperaturami. Skoro podane gazy zmieszane ze sobą stanowią "jedno i to samo" powietrze, to znaczy, że ich temperatury są sobie równe. Stąd wyznaczymy zależność między prędkościami (wiedząc jakie są masy cząsteczek tych gazów).