zadanie domowe nr 8, część 1, zadanie 7

Witam, mam parę pytań odnośnie tego zadania.
Dlaczego w tym podpunkcie zakładamy ze ciśnienia są takie same?
Czy jeśli mamy do czynienia z gazem doskonałym to zawsze "musi" zachodzić jakaś przemiana? W tym przypadku przemiana nie jest ani izotermiczna, ani izochoryczna to musi być izobaryczna?
Czy moje rozwiazanie jest prawidłowe? Wynik wychodzi "dobry" (myślę ze różnica 1 K jest spowodowana zaokrągleniem), jednak podążając moimi obliczeniami, ciśnienia nie są takie same. Dodatkowo nie potrafię sobie uzmysłowić w jaki sposób ta wartość pracy z pierwszego podpunktu tutaj ma tutaj zastosowanie.
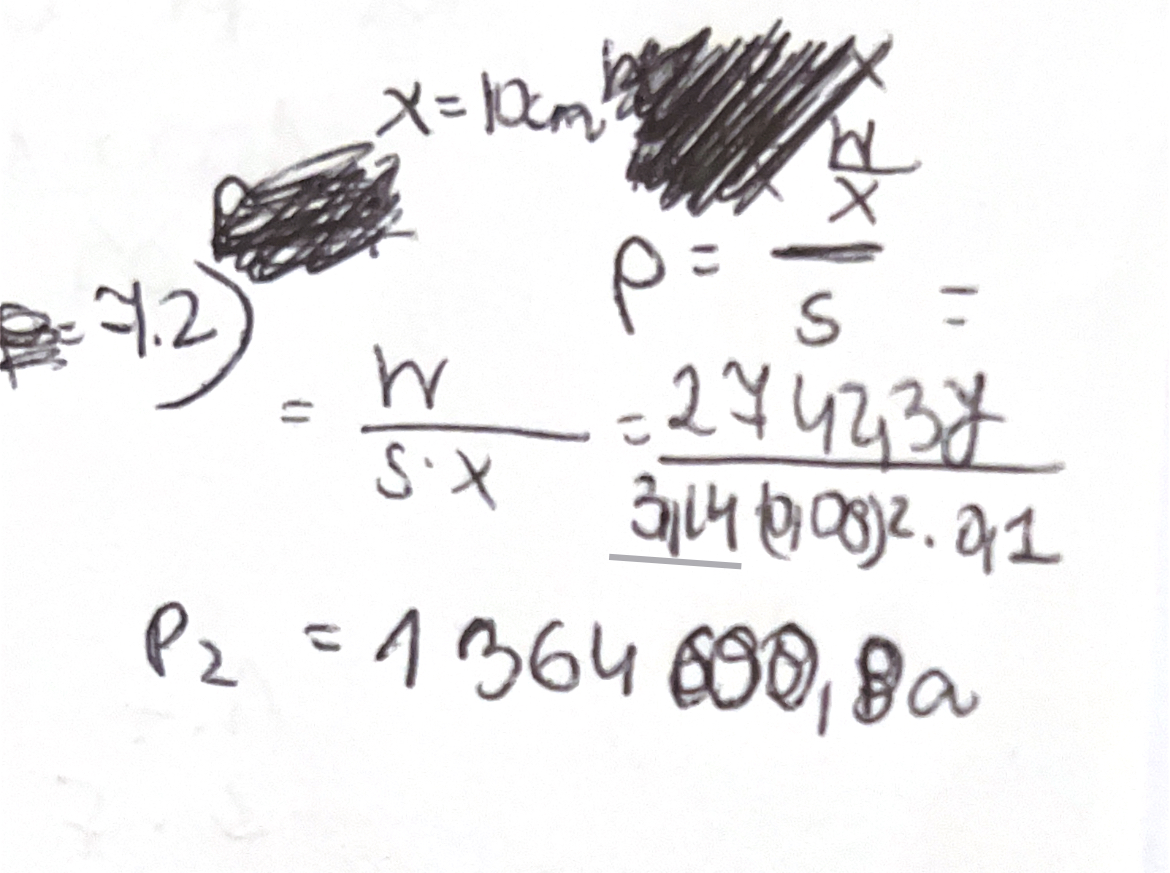
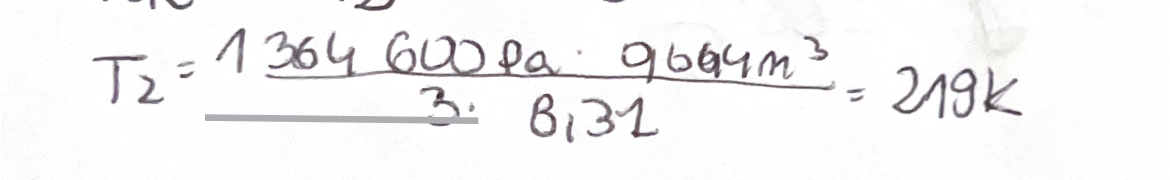
Wartości które posiadałam przymierzając się do tego podpunktu to
n=3 p1= 1 371 150 Pa, T1= 330K, V1=0,006m^3 oraz V2=0,004m^3
fizyka termodynamika Dodaj post do ulubionych Poproś o pomoc
- 1
- Zaloguj się lub zarejestruj, by móc oceniać komentarze.
- Dodaj do ulubionych
Co do pierwszego pytania, to zgodnie z tym co mówiliśmy na zajęciach, gdy mamy "swobodny" tłok (czyli nie przykładamy do niego żadnej dodatkowej siły, czyli np. nie przytrzymujemy go "sztucznie" w jakiejś jednej pozycji albo też nie przesuwamy go w określony sposób, tylko dajemy mu się swobodnie przemieszczać), to mamy wtedy do czynienia z przemianą izobaryczną i dlatego taka tutaj ona jest. I w ogólności, jeśli zmieniają się parametry gazu (p, V lub T) to faktycznie zawsze jest to "jakaś" przemiana. Na maturze najczęściej będzie to przemiana izobaryczna, izochoryczna lub izotermiczna, ale oczywiście w ogólności może to być zupełnie inna przemiana, np. adiabatyczna czy jeszcze jakaś inna, nie będąca żadną z tych wymienionych. Możemy natomiast też mieć przypadek gdy mamy gaz doskonały, ale nic z nim nie robimy, więc nie poddajemy go żadnej przemianie, czyli znajduje się on cały czas w takim samym stanie i wtedy też oczywiście mogą nas prosić o obliczenie czegoś (liczyliśmy sobie np. masę gazu w jednym z zadań na zajęciach) - wtedy cały czas możemy oczywiście korzystać z równania Clapeyrona.
Co do drugiego obliczenia, to przy obliczeniu ciśnienia masz mały błąd, mianowicie gdy liczysz powierzchnię tłoka, to do wzoru pi*r^2 wrzucamy promień, a nie średnicę koła ;) więc tam powinno być (0,04)^2, a nie (0,08)^2 i wtedy ciśnienie wyjdzie Ci 4 razy większe (jak w odpowiedziach).
I teraz w tym obliczeniu temperatury wygląda na to, że masz dwa błędy, ale jakimś trafem się one skompensowały i dały dobry wynik :P
Mianowicie w miejsce ciśnienia powinnaś wrzucić już poprawnie obliczone ciśnienie (czyli te 5,458 MPa), a w miejsce objętości powinnaś wrzucić poprawnie obliczoną objętość całego gazu w położeniu nr 2 - czyli jest to objętośc walca o wysokości 20 cm i promieniu 4 cm, objętość ta zatem powinna wynosić V = 3,14 * (0,04 m)^2 * 0,2 m = 1,0048*10^-3 m^3.
Jeśli użyjesz takich wartości to temperatura wyjdzie Ci niemal dokładnie równa 220 K.