arkusz 9 zad 6
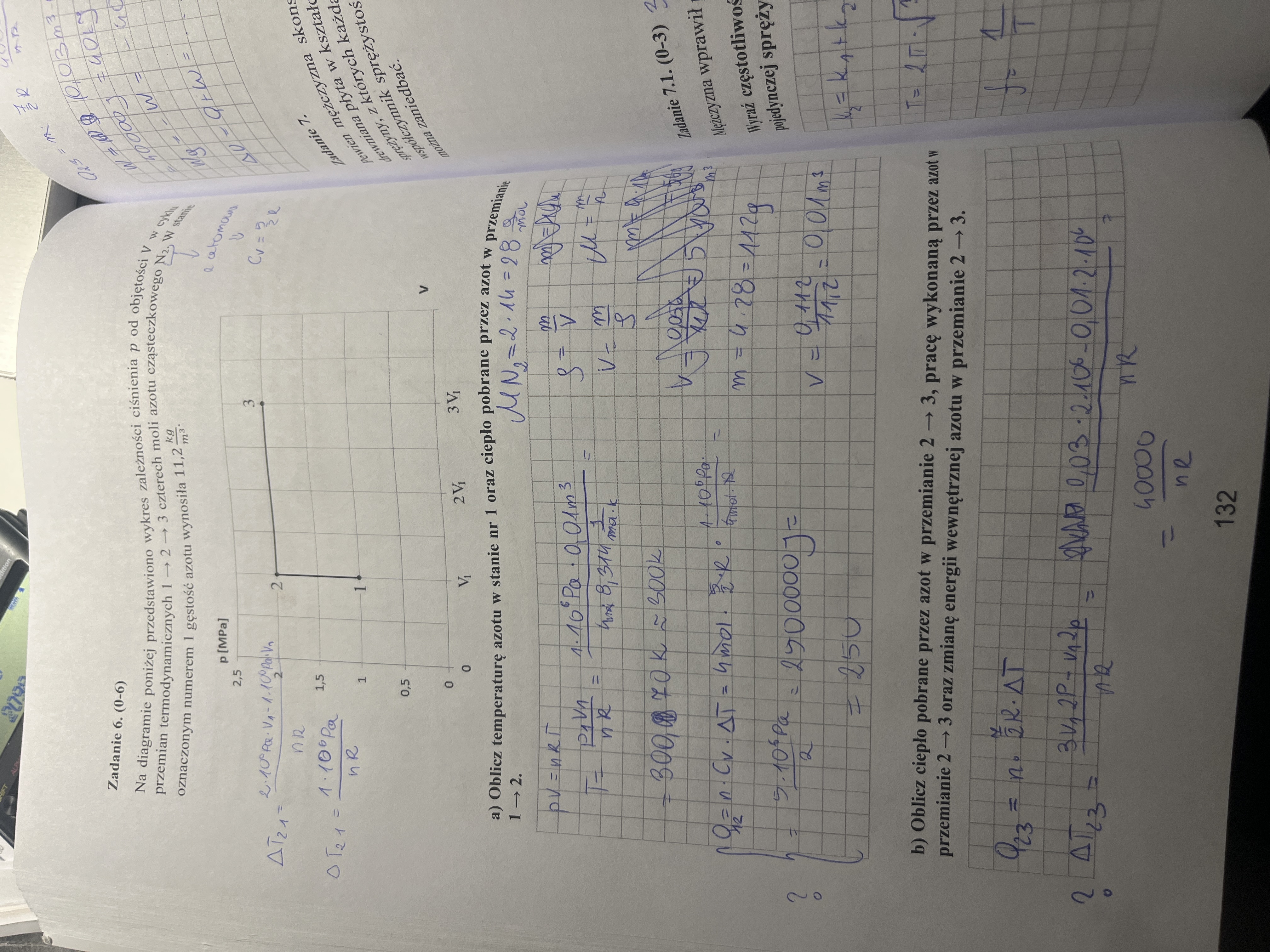

mam kilka pytań :)
a) jak liczymy ciepło Q12 to wydaje mi się że delta T wynosi tutaj 1*10^6Pa/nR ( tak jak zapisałam przy wykresie) a w odpowiedziach jest że wzrosła dwukrotnie? dlaczego jak mamy w zasadzie 2-1 czyli 1
b) tutaj ten sam problem z delta T23… 0,03-0,01 to będzie 0,02 * 2* 10^6… także nie wiem czy coś robię źle czy źle to rozumiem czy jak :)
b) jak chodzi o ten pp to mam też pytanie jak liczymy pracę (liczę jako pole pod wykresem przemiany) to wydaje mi się że ta praca policzona to jest praca wykonana przez siły zewnętrzne. analogiczne praca wykonana przez gaz będzie z przeciwnym znakiem a co za tym idzie delta U byłaby większa niż w odp… czy tutaj jest jakoś na odwrót czy o co chodzi ;)
ciepło Dodaj post do ulubionych Poproś o pomoc
- 1
- Zaloguj się lub zarejestruj, by móc oceniać komentarze.
- Dodaj do ulubionych
a) 1*10^6 Pa/nR musi być jeszcze przemnożone przez V1 (miałaś to zapisane w pierwszej linijce ale potem to zgubiłaś). I to jest prawda, a jednocześnie oznacza to, że temperatura wzrosła dwukrotnie :) nie ma tu żadnej sprzeczności między tymi stwierdzeniami. (Początkowa temperatura to było 1*10^6 Pa*V1, a końcowa to 2*10^6 Pa*V1). Chyba, że nie zrozumiałem pytania?
b) Odpowiedź analogiczna jak poprzednio :D
b) Jeśli chodzi o pracę, to co do wartości bezwzględnej jest to zarówno praca gazu, jak i praca wykonana przez siły zewnętrzne (nad gazem). Trzeba tylko stwierdzić poprawnie która z nich jest z plusem, a która z minusem. Widzimy, że w przemianie 2-3 objętość gazu rośnie, więc praca wykonana przez gaz jest dodatnia, a zatem praca sił zewnętrznych jest ujemna. Więc praca, którą wrzucamy do I zasady termodynamiki, z uwagi na fakt, że jest to praca sił zewnętrznych własnie, musi być ujemna (W = - 40 kJ, a praca gazu Wg = +40 kJ). Więc z I ZTD wyjdzie nam: deltaU = Q + W = 140 kJ - 40 kJ = 100 kJ.